Am 1. April wurde auf der Website der “Public Health and Medical Professionals for Transparency“, die in den USA die Veröffentlichung der Pfizer-Zulassungsdokumente erwirkt haben, eine Wiederveröffentlichung eines bereits aus dem November 2021 bekannten Dokuments zum Download bereitgestellt: In diesem werden die bis zum 28. Februar 2021 gemeldeten Nebenwirkungen des Pfizer-Vakzins erörtert. Das Dokument enthält einen überaus interessanten neuen Absatz, aus dem hervorgeht, dass Pfizer massenhaft neue Mitarbeiter einstellen musste, um die hohe Zahl von Nebenwirkungsmeldungen bearbeiten zu können.
Schon die erste Veröffentlichung dieser Analyse gemeldeter Nebenwirkungen hatte weltweit Skandale ausgelöst, ging daraus immerhin hervor, dass binnen kürzester Zeit nach der Notfallzulassung des sogenannten Impfstoffs in den USA eine unglaubliche Masse möglicher Nebenwirkungen und unerwünschter Reaktionen bekannt geworden war – was jedoch weder Pfizer noch die FDA dazu bewogen hat, die Sicherheit des Vakzins zu hinterfragen. Ob Zulassungsbehörden im Ausland dieser Bericht ebenfalls vorlag, blieb unklar – für viele lag und liegt der Verdacht nahe, dass die sich in der Analyse abzeichnenden Risiken bekannt waren, aber schlichtweg ignoriert wurden.
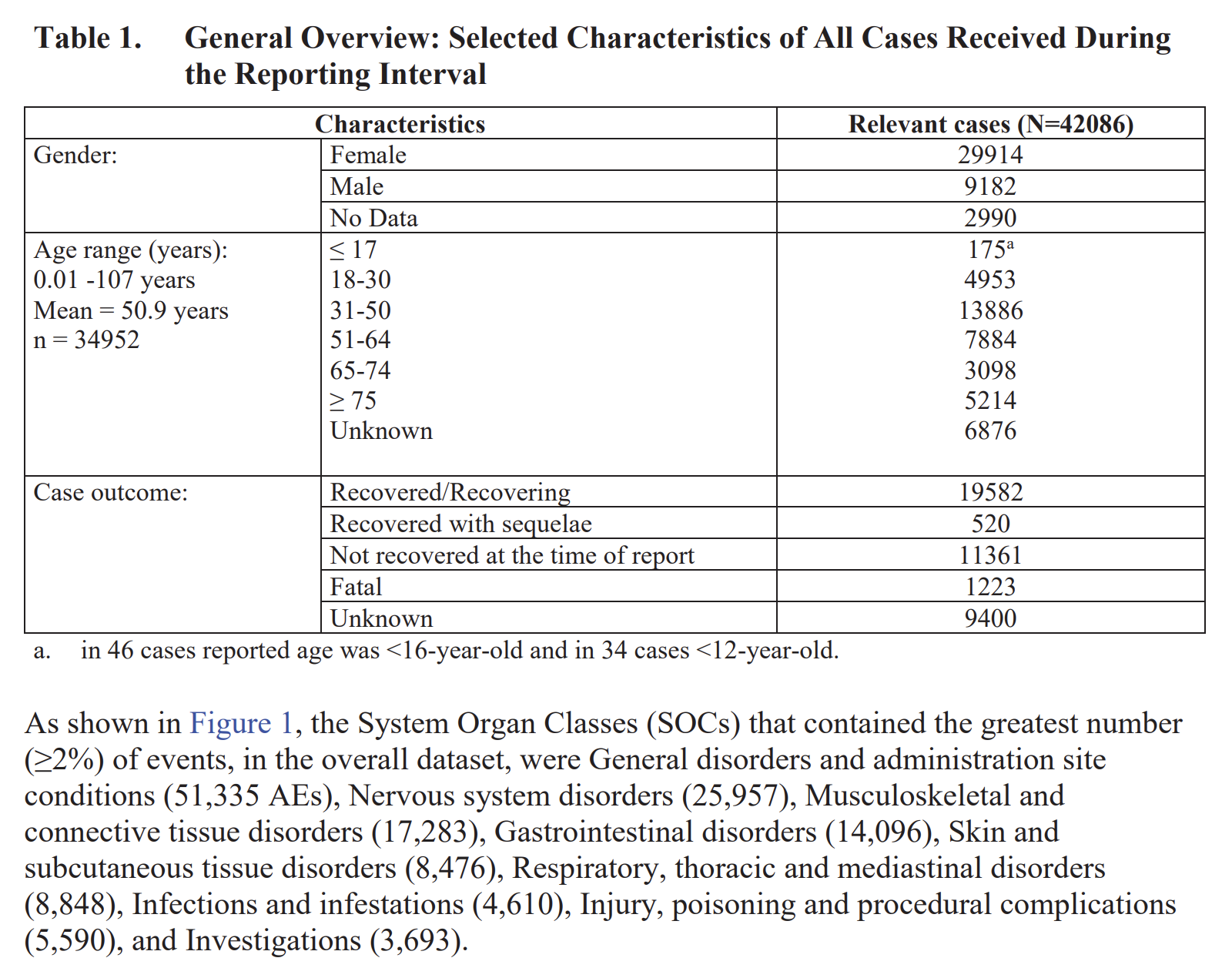
In der neuen Version des besagten Dokuments findet sich nun ein Absatz, der weiteren Aufschluss darüber gibt, in welchem Ausmaß der Pharma-Riese von Nebenwirkungsmeldungen überschüttet wurde.
Dort ist nämlich nicht nur zu lesen, dass aufgrund der hohen Zahlen von Meldungen schwere Fälle priorisiert werden mussten, sondern auch, dass Pfizer zum Zeitpunkt des Berichts bereits 600 neue Vollzeit-Mitarbeiter eingestellt hatte, die die eingehenden Meldungen bearbeiten sollten. Und damit nicht genug: Binnen kürzester Zeit, nämlich bis Ende Juni 2021, sollte die Zahl neu eingestellter Mitarbeiter auf insgesamt stolze 1.800 steigen.
Due to the large numbers of spontaneous adverse event reports received for the product, the MAH has prioritised the processing of serious cases, in order to meet expedited regulatory reporting timelines and ensure these reports are available for signal detection and evaluation activity. The increased volume of reports has not impacted case processing for serious reports, and compliance metrics continue to be monitored weekly with prompt action taken as needed to maintain compliance with expedited reporting obligations. Non-serious cases are entered into the safety database no later than 4 calendar days from receipt. Entrance into the database includes the coding of all adverse events; this allow for a manual review of events being received but may not include immediate case processing to completion. Non-serious cases are processed as soon as possible and no later than 90 days from receipt. Pfizer has also taken a multiple actions to help alleviate the large increase of adverse event reports. This includes significant technology enhancements, and process and workflow solutions, as well as increasing the number of data entry and case processing colleagues. To date, Pfizer has onboarded approximately 600 additional fulltime employees (FTEs). More are joining each month with an expected total of more than 1,800 additional resources by the end of June 2021.
Quelle (S. 6)
Ins Deutsche übersetzt:
Aufgrund der großen Anzahl von spontanen Berichten über unerwünschte Ereignisse, die für das Produkt eingegangen sind, hat der Inhaber der Genehmigung für das Inverkehrbringen die Bearbeitung schwerwiegender Fälle priorisiert, um beschleunigte behördliche Meldefristen einzuhalten und sicherzustellen, dass diese Berichte für Signalerkennungs- und Bewertungsaktivitäten verfügbar sind. Das erhöhte Meldevolumen hat sich nicht auf die Fallbearbeitung bei schwerwiegenden Meldungen ausgewirkt, und die Compliance-Metriken werden weiterhin wöchentlich überwacht, wobei bei Bedarf umgehend Maßnahmen ergriffen werden, um die Einhaltung der beschleunigten Meldepflichten aufrechtzuerhalten. Nicht schwerwiegende Fälle werden spätestens 4 Kalendertage nach Eingang in die Sicherheitsdatenbank aufgenommen. Der Eintrag in die Datenbank beinhaltet die Kodierung aller unerwünschten Ereignisse; Dies ermöglicht eine manuelle Überprüfung der empfangenen Ereignisse, beinhaltet jedoch möglicherweise keine sofortige Fallbearbeitung bis zum Abschluss. Nicht schwerwiegende Fälle werden so schnell wie möglich und spätestens 90 Tage nach Eingang bearbeitet. Pfizer hat außerdem mehrere Maßnahmen ergriffen, um die starke Zunahme der Berichte über unerwünschte Ereignisse zu verringern. Dazu gehören bedeutende technologische Verbesserungen und Prozess- und Workflow-Lösungen sowie die Erhöhung der Anzahl der Kollegen für die Dateneingabe und Fallbearbeitung. Bis heute hat Pfizer rund 600 zusätzliche Vollzeitmitarbeiter (FTEs) eingestellt. Jeden Monat kommen weitere dazu, bis Ende Juni 2021 werden insgesamt mehr als 1.800 zusätzliche Ressourcen erwartet.
Finally got the unredacted version of this FoIA’d document. Three months after the release of the vaccine Pfizer had to hire 600 additional full-time employees, with a plan to hire 1800 total, just to process the flood of adverse events reported. pic.twitter.com/5emJ0s9djl
— Aaron Kheriaty, MD (@akheriaty) April 4, 2022
Während gemeinhin gern behauptet wird, dass Verdachtsmeldungen von Impfnebenwirkungen reine Zufallsbefunde sind, zeigen Analysen von Daten aus dem VAERS-System sehr wohl, dass die Kausalität von gemeldeten Gesundheitsproblemen zur Impfung in etlichen Fällen naheliegt (Report24 berichtete: ‘Datenanalystin zu Nebenwirkungsmeldungen: Keine Zufälle – Kausalität zur Impfung naheliegend‘). Nicht umsonst gelten heute zahlreiche Nebenwirkungen der Vakzine als bestätigt und werden in den Produktinformationen genannt. Dass ausgerechnet ein Pharma-Gigant, der sein Produkt verkaufen möchte, Sicherheitssignale wirklich ernst nimmt, darf bezweifelt werden – nicht zuletzt, da auch die klinischen Studien zur Gentherapie gegen Covid von Pfizer und BioNTech gravierende Mängel aufwiesen.









